在前期的一些文章中多次提到了理想气体状态方程这个概念,可能有的小伙伴对此不太了解,今天就以这篇文章向读者作简要介绍。
假设有这样一种气体,它在任何温度和任何压力下都能严格遵守气体实验规律,我们就把这种气体成为“理想气体”,它满足以下条件:分子间除碰撞外没有其他的作用力(即内能只有分子动能,没有分子势能)、分子自身体积可以忽略。从这个定义我们可以知道,理想气体分子间没有吸引力或者排斥力,也就是黏度为0。这样的气体遵循以下规律:
PV=nRT
其中 P 是气体压力(压强),V 是气体体积,n 是物质的量,R 是理想气体常数,T 气体热力学温度。这就是著名的理想气体状态方程。这个方程揭示的气体体积与压力和温度的关系:一定量的理想气体体积与压力成反比,与温度成正比。
这个结论对于气体测量至关重要。然而理想气体是不存在的,我们依然可以对常见气体使用这个方程的原因是常见气体在压力不太大、温度不太低的情况下黏度非常小,通常在10-5至10-6量级。我们首先来看这个方程在气体测量方面最重要的应用:通过工况体积计算标况体积。
例1.现有一容积50L的气瓶充满氮气,测得此时气瓶压力为202.65kPa、温度为25℃,计算这瓶氮气在标况下(101.325kPa、25℃)体积是多少。
答:将两种状态下的温度、压力、体积分别带入理想气体状态方程:
202.65×50=nR(273.15+25)
101.325×V=nR(273.15+25)
两式相除,约掉nR,算出这瓶氮气在标况下的体积是100L。
从这个例子里可以很直观地感受到,压力减小一半,体积增大两倍。
我们再看一个更有趣的应用。
例2.怎样测量一个异形容器的容积。
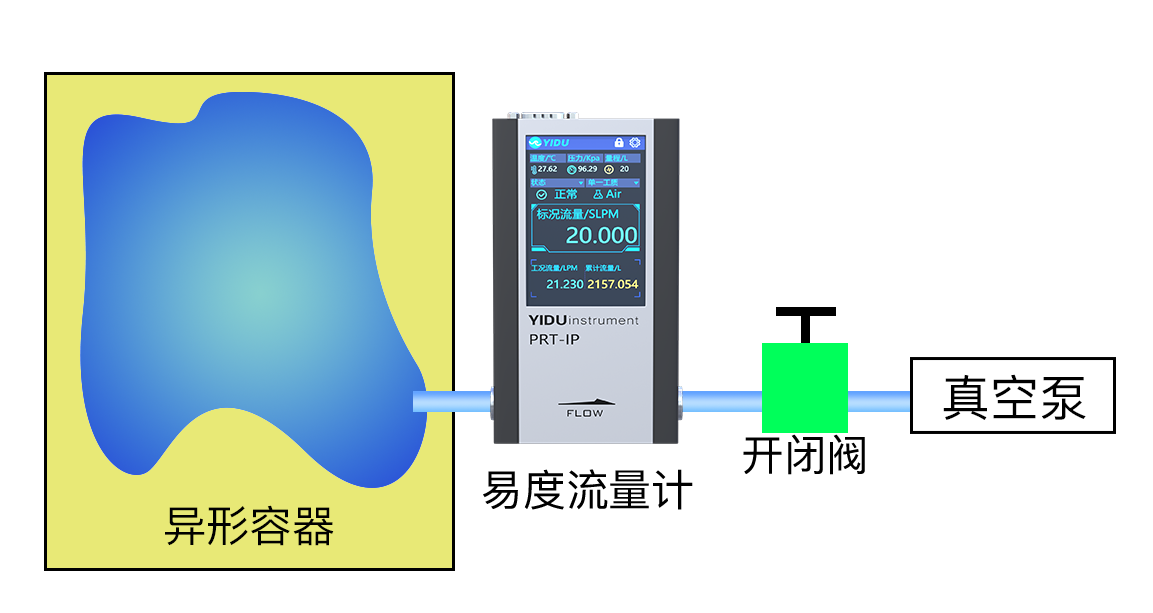
答:实验在空气环境下进行,实验装置如图所示。实验过程:通过易度流量计读取压力值P0、温度值T0,通过真空泵抽气,一段时间后关闭真空泵,通过易度流量计读取压力值P1、温度值T1和累计标况流量ΔV,先按照例1的方法计算出ΔV在P0、T0状态下的体积ΔV0,设异形容积为V0,将两个状态下的温度、压力、体积分别带入理想气体状态方程:
P0V0=nRT0
P1(V0-ΔV0)=nRT1
联立两个方程,就可求解出异形容积V0了。
你还知道哪些有趣的理想气体状态方程应用案例呢?
 S系列气体层流质量流量计
S系列气体层流质量流量计 P系列便携式气体层流质量流量计
P系列便携式气体层流质量流量计 SC系列层流质量流量控制器
SC系列层流质量流量控制器 MC系列层流质量流量控制器
MC系列层流质量流量控制器







